Botanique
L'ordre des Asparagales
-->sommaire
Les Asparagales sont un groupe trés récent, se voulant d'une taxonomie réfletant la phylogénie (Vous en saurez plus en lisant cette page d'ailleurs). Cette page reste trés orientée pollen, pour la simple et bonne raison qu'il s'agit d'un morceau tiré de ma thèse. Je n'ai pas essayé de retravailler vraiment le texte, mais j'ai quand même rajouté plein d'illustrations... Ce clade est non seulement diversifié au niveau de la morphologie des pollens qu’on peut y recenser mais il a également fait l’objet de plusieurs études sur l’une des étapes de la microsporogénèse, le type de cytocinèse, qui est une des étapes intervenant dans le modèle. L’ordre des Asparagales est l'un de ces groupes ayant émergé des travaux récents de clarification concernant la classification et la phylogénie des Monocotylédones (Chase et al. 1995). Il est composé de familles reconnues en tant qu'entités systématiques par leur singularité, comme de familles définies plus récemment et dont l'existence relève plus spécifiquement de l'apport de la phylogénie. Dans ce cas les fondements morphologiques de la classification botanique conventionnelle sont plus ténus, quand bien même les données de phylogénie moléculaire donnent des résultats convergents. Enfin, cet ordre est un groupe clé des Monocotylédones en raison de sa diversité spécifique (Pires et al. 2004, sous presse ; voir tableau 1).
- Historique de la classification et phylogénie des Asparagales
- Les apports de la phylogénie moléculaire dans la classification des Asparagales
- Les enjeux récents de la systématique des Asparagales
- Diversité du type apertural des Asparagales sur le plan systématique
- Organisation de la diversité du type apertural chez les Asparagales
- Bibliographie
Historique de la classification et phylogénie des Asparagales
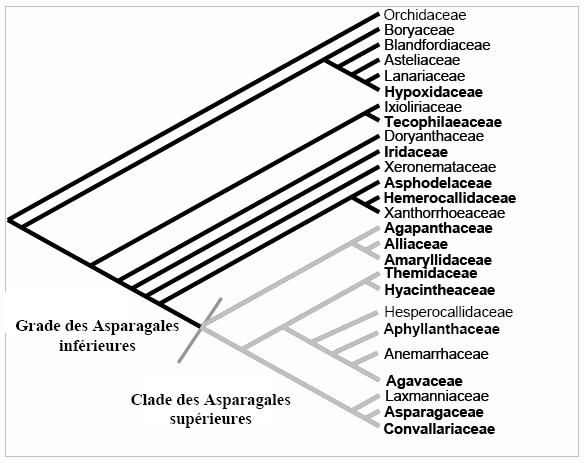
Figure 1 : Phylogénie des familles d'Asparagales
(sensu Angiosperm Phylogeny Group 2003). En gras, les
familles pour lesquelles des données ont été obtenue
au cours de cette étude.
La classification des Asparagales et du groupe morphologique lui ressemblant, les Liliales, a fait l’objet de nombreux travaux et d’un long débat entre systématiciens (consulter l’encadré 1 et le tableau 2, pages suivantes). Suivant les caractères étudiés, les regroupements taxonomiques ont beaucoup varié. En particulier, les Asparagales et les Liliales ont toujours été considérées comme un ensemble unique mais disparate.
Finalement, les phylogénies moléculaires ont substantiellement éclairci les relations évolutives et ont été à l’origine de profonds remaniements dans le groupe des Monocotylédones lilioïdes. Les phylogénies moléculaires ont notamment permis de dissocier ces deux ordres, dont l’origine évolutive est finalement distincte. Nous nous placerons donc, dans cette étude, sous l’angle phylogénétique de l’ordre des Asparagales. Sa phylogénie fait aujourd’hui consensus (figure 1), elle a été confirmée par de nombreuses phylogénies utilisant des séquences moléculaires différentes.
(Note: Les dénominations respectives de Asparagales « inférieures » et Asparagales « supérieures » sont utilisées dans ce document pour conserver la convention actuelle d’usage chez les Asparagales. Elles ne reflètent aucune prise de position vis-à-vis des connotations anciennement attribuées à ces termes, et en particulier la signification comparative et désuète liée à la ‘scala naturae’ lamarckienne. Elles ne reflètent que la décision arbitraire de délimiter le clade des Asparagales supérieures par la synapomorphie de la cytocinèse simultanée.)
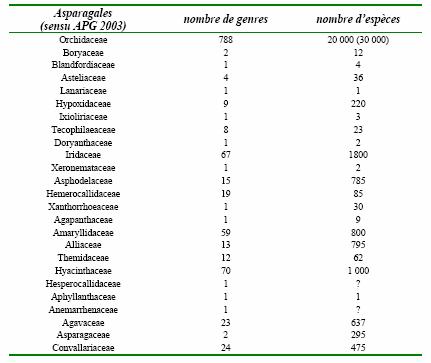
Tableau 1: Nombre de genres et d'espèces des différentes familles d'Asparagales
(l’ordre de
rangement est phylogénétique, consulter figure 1).
<--
Encadré 1 : Historique de la classification des Asparagales

Une Asparagale!

Une Liliale!

Ce travail de détermination de caractères morphologiques pertinents en ce qui concerne ces groupes de plantes, a montré la difficulté à apporter une réponse claire en utilisant une approche cladistique basée sur la morphologie. Les caractères morphologiques permettent donc difficilement une discrimination satisfaisante des familles chez les Asparagales (Rudall et Cutler 1995), soit parce qu’ils présentent une trop grande homoplasie, soit qu’ils ne sont pas généraux dans les différentes familles, soit aussi parce que leur combinaison n’est pas assez informative dès que l’on s’intéresse à l’histoire évolutive du groupe.
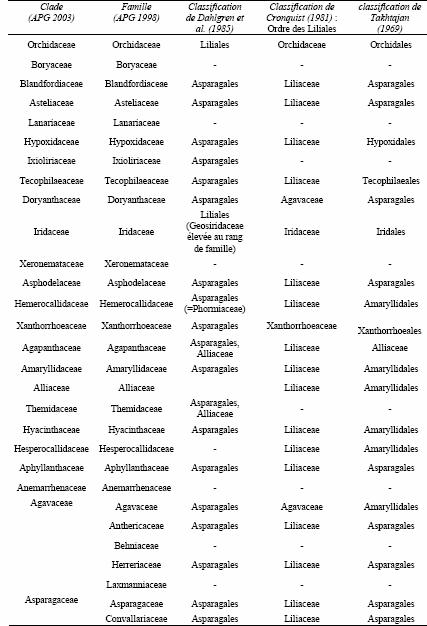
Tableau 2: Répartition des différentes familles d’Asparagales actuelles au sein des
différentes classifications du groupe des « Liliales ». Thorne (1968) regroupait indistinctement
toutes ces familles au sein des Lilianae-Orchidales. Takhtajan (1969) et Cronquist (1981) sont
indiqués pour illustrer l'absence de recoupements existant entre classifications établies sur des
critères différents. Les (-) indiquent des familles issues de la phylogénie moléculaire, composées
d'espèces classées à l'état dispersé dans des familles selon les classifications précédentes, et
dont il n'a pas été retracé l'appartenance. Dahlgren et al. (1985) regroupaient également avec les
Asparagales les familles suivantes, qui en sont aujourd’hui exclues : Philesiaceae, Luzuriagaceae,
Dracenaceae, Nolinaceae, Asteliaceae, Hanguanaceae, Dasypogonaceae, Calectasiaceae,
Cyanastraceae, Eriospermaceae, Funkiaceae.
<--
Les apports de la phylogénie moléculaire dans la classification des Asparagales
Les premières phylogénies moléculaires des Lilianae (Asparagales et Liliales sensu Dahlgren 1985) sont celles de Duvall et al. (1993) et Chase et al. (1995). Les résultats obtenus ont confirmé les doutes réitérés concernant la classification de ces plantes : les groupes taxonomiques définis se sont souvent montrés sans fondement au regard des résultats de la phylogénie moléculaire, toute l’artificialité des affiliations étant reflétée par la polyphylie des ordres par rapport à la classification qui était la plus utilisée, celle de Dahlgren et al. (1985). Ces phylogénies moléculaires des Asparagales et Liliales ont donc conduit à une révision conséquente des regroupements des différentes familles et de leur composition en espèces (consulter le tableau 1 pour l’importance relative des familles en terme de richesse spécifique).

Une Iridaceae (du Genre Romulea).
Les principaux changements concernant les Asparagales sont les suivants :
- Le classement des Orchidaceae et des Iridaceae dans les Asparagales, placées auparavant au sein des Liliales par Dahlgren et al. (1985).
- L’émergence ou la ‘résurrection’ de familles comportant un faible nombre de genres et/ou d’espèces et à la position taxonomique considérée auparavant comme incertaine (entrent dans ce cas surtout des familles des Asparagales ‘inférieures’ : Boryaceae, Blandfordiaceae, Lanariaceae, Asteliaceae, etc.).
- De nombreuses espèces rangées dans certaines familles sur la base de critères morphologiques sont reclassées dans d’autres familles ou d’autres ordres sur la base de ces résultats.
La nouvelle classification des Asparagales a été confortée par d’autres travaux de phylogénie moléculaire basés sur plusieurs gènes, notamment celle obtenue sur la base de quatre séquences moléculaires (Fay et al. 2000). Les études de phylogénies à l'échelle des Monocotylédones montrent que le groupe des Lilianae (sensu Dahlgren et al. 1985) n'était pas naturel car il s'avère paraphylétique (Duvall et al. 1993).
La réhabilitation du statut familial des petits groupes (tableau 1), ainsi que la reformulation de la classification se confirme (APG 2003 ; Pires et al. 2004, sous presse). Il reste à présent à éclaircir les phylogénies intra-familiales. La définition plus fine de ces relations intrafamiliales grâce aux phylogénies moléculaires s’étend pour l’instant aux familles les plus connues, comme les Asphodelaceae (Chase et al. 2000a), les Hyacinthaceae (Pfosser et Speta 1999 ; Pfosser et al. 2003), les Agavaceae (Bogler et Simpson 1996) et les Amaryllidaceae (Meerow et al. 1999 ; Ito et al. 1999) ou à d’autres familles plus circonscrites (géographiquement, mais aussi en terme de richesse spécifique), comme les Themidaceae (Fay et Chase 1996). Ces études concernent parfois le niveau générique, particulièrement lorsque les données moléculaires sont en conflit avec les données morphologiques, comme par exemple pour Haworthia, dans la sous-famille des Alooideae (Treutlein et al. 2003). Il semble néanmoins qu’une augmentation de l’échantillonnage apportera plus de précisions tant à la définition des familles (et des genres) qu’à leurs positions relatives au sein de l’ordre des Asparagales.
<--Les enjeux récents de la systématique des Asparagales

Une Iridaceae (du Genre Moraea).
Le phénomène de convergence est conforté par les études cladistiques récentes de Rudall (2002) ou Zomfeler (1999), basées sur des données anatomo-morphologiques. Cette recherche systématique de caractéristiques taxonomiques appropriées prend parfois la forme d’un survol synthétique du clade, comme cela a été conduit chez les Asparagales inférieures sur des critères morphologiques floraux (Kocyan et Endress 2001) ou encore d’études plutôt centrées au niveau de familles phylogénétiques : Asteliaceae et Hypoxidaceae (Rudall et al. 1998), Anthericaceae (Chase et al. 1996), Alliaceae (Rudall et al. 2002), Convallariaceae (Rudall et Campbell 1999). Les familles recirconscrites à partir des Anthericaceae comme les Lomandraceae et les Boryaceae (Chase et al. 1996), les Xeronemataceae (Chase et al. 2000b) ou celles résultant de la résurrection d’anciennes familles comme les Themidaceae (Fay et Chase 1996) ont reçu une certaine attention.

Une Watsonia (Iridaceae), ressemblant
pourtant plus a une Hyacinthaceae.
Cependant, des études détaillées manquent encore pour certaines familles (Blandfordiaceae, Doryanthaceae, Xanthorrhoeaceae, Laxmanniaceae, Anemarrhenaceae, Behniaceae), que ce soit à propos de leur morphologie ou de leur composition en espèces (le tableau 1 donne l’importance relative des différentes familles à l’heure actuelle). A ce jour, et toujours en raison d’une forte homoplasie des caractères morphologiques au sein de ce groupe, aucune série de caractères ne permet de dresser une taxonomie logique reflétant la phylogénie moléculaire. On retrouve ce phénomène aussi bien pour les caractères utilisés par Dahlgren (1985), concernant surtout la morphologie des graines, que pour des caractères racinaires (Kauff et al. 2000), dont l’homoplasie reflète probablement des adaptations convergentes aux milieux xériques. Dans le grade des Asparagales inférieures, certains taxons possédant des caractéristiques en commun avec des groupes phylogénétiquement éloignés (Xanthorrhoea, Lanaria) viennent perturber la topologie des arbres basés sur les analyses cladistiques (Rudall 2002). Les caractères moléculaires, tels l’absence ou la présence d’un gène (tableau 3), sont souvent des caractéristiques de l’ordre entier, à quelques exceptions près. Leur utilisation n’est donc pas d’une plus grande aide.
Parmi les nombreux caractères faisant l’objet d’investigations, on peut noter que certains concernent la microsporogénèse, en particulier le type de cytocinèse. Ce critère s'est révélé utile dans certains cas où la morphologie florale était insuffisante. Par exemple il a permis de distinguer les Anthericaceae, rangées à l’heure actuelle au sein des Agavaceae (APG 2003), qui ont une cytocinèse successive, des Asphodelaceae, qui ont une cytocinèse simultanée (Dahlgren et al. 1985 ; Stedge et Nordal 1994 ; Kativu 1996). La cytocinèse successive est considérée comme une synapomorphie du clade des Asparagales supérieures (Duvall et al. 1993 ; Chase et al. 1995; Rudall et al. 1997). <--
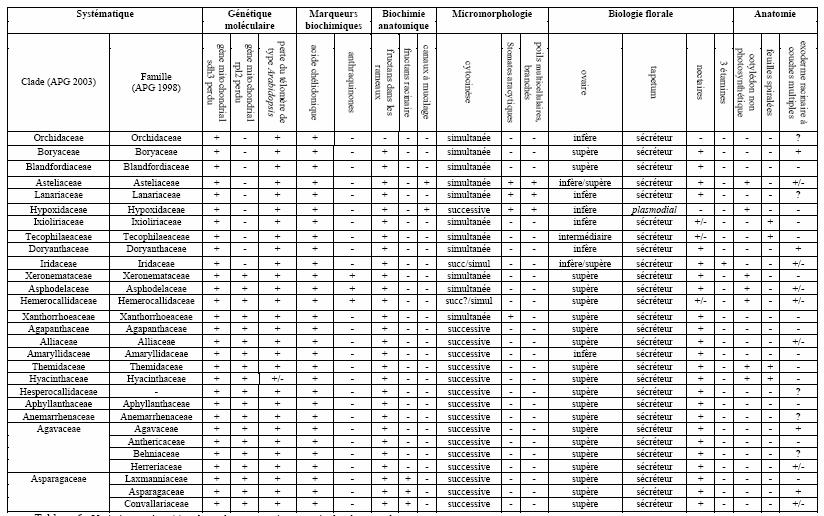
Tableau 3: Variation et répartition de quelques caractères au sein des Asparagales.
<--
Diversité du type apertural des Asparagales sur le plan systématique
En tant que caractère morphologique fiable et facilement identifiable (au moins pour un travail systématique de classification des espèces), la morphologie du pollen, et en particulier le type apertural (= la forme et le nombre des ouvertures élaborées sur la parois du grain de pollen), a été beaucoup étudiée chez les Angiospermes. La première tentative de recensement des morphologies du pollen, sans prétention systématique mais avec un réel effort d’exhaustivité (centré sur l’ensemble des Angiospermes), est le travail de Erdtman (1952). Ce travail présente une description complète de la diversité pollinique rencontrée chez les Angiospermes.
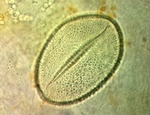
Grain de pollen monosulqué.
Si certains caractères du pollen sont utiles d'un point de vue systématique, ce n'est pas toujours le cas. Ainsi, pour les Asparagales, le type apertural n’offre qu’une faible aptitude à prédire l’appartenance d’une espèce donnée à un quelconque groupe systématique. En effet, d'une part une morphologie (pollen monosulqué) est prépondérante et d'autre part la plupart des morphologies rencontrées dans cet ordre se retrouvent également dans d’autres ordres. Le type apertural ne représente un critère valable de classification que pour différencier certaines espèces dans un genre donné.
L’utilité systématique du type apertural semble en effet circonscrite à des échelles taxonomiques relativement réduites : genre et sous-divisions du genre, comme c'est le cas pour le genre Aristea (Iridaceae), qui présente une diversité surprenante du type apertural (Goldblatt et al. 2004). Certains types de pollen peuvent cependant parfois être diagnostiques à de plus grandes échelles, comme la présence de pollen di-sulqué chez les Tigridioideae (une sous-famille des Iridaceae ; Rudall et Wheeler 1988). Un autre exemple est la présence caractéristique de pollen trichotomosulqué chez les Hemerocallidaceae, chez qui seules les espèces du genre Hemerocallis produisent uniquement du pollen monosulqué (Rudall et al. 1997 ; Xiong et al. 1998).
Organisation de la diversité du type apertural chez les Asparagales
En dépit de son manque d’intérêt sur le plan systématique, le type apertural varie cependant au sein des différentes familles :
- Le pollen monosulqué est la morphologie prépondérante dans toutes les familles.
- Du pollen trichotomosulqué est régulièrement observé en association avec du pollen monosulqué dans le cas des espèces à cytocinèse simultanée, et est parfois la forme de pollen majoritaire, notamment pour les espèces du « clade trichotomosulqué » (Rudall et al. 1997).
- Les Iridaceae sont la famille la plus diversifiée au niveau du type apertural : on y recense des pollens monosulqués, trichotomosulqués, disulqués, triaperturés, zonasulqués, ou encore inaperturés.
- Le clade des Asparagales supérieures est très homogène (pollen monosulqué) mais d'autres morphologies aperturales sont parfois rencontrées, comme le pollen disulqué, ou encore plus occasionnellement le pollen zonasulqué ou inaperturé.
Bibliographie
Angiosperm Phylogeny Group. 2003. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG II. Botanical Journal of the Linnean Society 141: 399-436.
Bogler, D. J., and B. B. Simpson. 1996. Phylogeny of Agavaceae based on ITS rDNA sequence variation. American Journal of Botany 83: 1225-1235.
Chase, M. W., M. R. Duvall, H. G. Hills, J. G. Conran, A. V. Cox, L. E. Eguiarte, J. Hartwell, M. F. Fay, L. R. Caddick, K. M. Cameron, and S. Hoot. 1995. Molecular phylogenetics of Lilianae. Pages 109-137 in P. J. Rudall, P. J. Cribb, D. F. Cutler, and C. J. Humphries, eds. Monocotyledons: systematics and evolution. Royal Botanic Gardens, Kew.
Chase, M. W., A. Y. De Bruijn, A. V. Cox, G. Reeves, P. Rudall, M. A. Johnson, and L. E. Eguiarte. 2000a. Phylogenetics of Asphodelaceae (Asparagales): an analysis of plastid rbcL and trnL-F DNA sequences. Annals of Botany 86: 935-951.
Chase, M. W., P. J. Rudall, M. F. Fay, and K. L. Stobart. 2000b. Xeronemataceae, a new family of asparagoid lilies from New Caledonia and New Zealand. Kew Bulletin 55: 865-870.
Dahlgren, R. M. T., H. T. Clifford, and P. F. Yeo. 1985. The families of the Monocotyledons. Springer-Verlag, Berlin, Heidelberg, New York, Tokyo.
Duvall, M. R., M. T. Clegg, M. W. Chase, W. D. Clark, W. J. Kress, H. G. Hills, L. E. Eguiarte, J. F. Smith, B. S. Gaut, E. A. Zimmer, and G. H. Learn. 1993. Phylogenetics hypotheses for the monocotyledons constructed from rbcL sequence data. Annals Of The Missouri Botanical Garden 80: 607-619.
Erdtman, G. 1952. Pollen Morphology and Plant Taxonomy. Angiosperms. Almqvist and Wiksell, Stockholm.
Fay, M., and M. W. Chase. 1996. Resurrection of Themidaceae for the Brodiaeae alliance, and recircumscription of Alliaceae, Amaryllidaceae and Agapanthoideae. Taxon 45: 441-451.
Fay, M. F., P. J. Rudall, S. Sullivan, K. L. Stobart, A. Y. de Bruijn, G. Reeves, F. Qamaruz- Zaman, W.-P. Hong, J. Joseph, W. J. Hahn, J. G. Conran, and M. W. Chase. 2000. Phylogenetic studies of Asparagales based on four plastid DNA regions. Pages 360-371 in K. L. Wilson and D. A. Morrison, eds. Monocots: Systematics and Evolution. CSIRO, Melbourne.
Goldblatt, P., A. Le Thomas, and M. Suarez-Cervera. 2004. Phylogeny of the Afro- Madagascan Aristea (Iridaceae) revisited in the light of new data on pollen morphology. Botanical Journal of the Linnean Society 144: 41-68.
Ito, M., A. Kawamoto, Y. Kita, T. Yukawa, and S. Kurita. 1999. Phylogenetic relationships of Amaryllidaceae based on MatK sequence data. Journal of Plant Research 112: 207- 216.
Kativu, S. 1996. A study on microsporogenesis and ovule morphology in Tropical African Anthericaceae and Asphodelaceae. Pages 477-480 in L. J. G. van der Maesen, ed. The biodiversity of African Plants. Kluwer Academic Publisher.
Kauff, F., P. Rudall, and J. Conran. 2000. Systematic root anatomy of Asparagales and other Monocotyledons. Plant Systematics and Evolution 223: 139-154.
Meerow, A. W., M. F. Fay, C. L. Guy, L. Quin-Bao, F. Q. Zaman , and M. W. Chase. 1999. Systematics of Amaryllidaceae based on cladistic analysis of plastid sequence data. American Journal of Botany 86: 1325-1345.
Pfosser, M., and F. Speta. 1999. Phylogenetics of Hyacinthaceae based on plastid DNA sequences. Annals of Missouri Botanical Garden 86: 852-875.
Pfosser, M., W. Wetschnig, S. Ungar, and G. Prenner. 2003. Phylogenetic relationships among genera of Massonieae (Hyacinthaceae) inferred from plastid DNA and seed morphology. Journal of Plant Research 116: 115-132.
Rudall, P., and D. F. Cutler. 1995. Asparagales: a reappraisal. Pages 157-168 in P. J. C. P. J. Rudall, D. F. Cutler and C. J. Humphries, ed. Monocotyledons: systematics and evolution. Royal Botanic Gardens, Kew.
Rudall, P. J., C. A. Furness, M. W. Chase, and M. F. Fay. 1997. Microsporogenesis and pollen sulcus type in Asparagales (Lilianae). Canadian Journal of Botany 75: 408-430.
Rudall, P., and A. Wheeler . 1988. Pollen morphology in Tigridieae (Iridaceae). Kew Bulletin 43: 693-701.
Stedge, B., and I. Nordal. 1994. A contribution to the discussion to the family delimitation of Anthericaceae versus Asphodelaceae. Pages 513-524. XIIIth Plenary meeting AETFAT. J. H. Seyani and A. C. Chikuni, Malawi.
Xiong, Z. T., S. Chen, D. Hong, and Y. Luo. 1998. Pollen morphology and its evolutionary significance in Hemerocallis (Liliaceae). Nordic Journal of Botany 18: 183-189.
<--